Wprowadzenie
Historia odkrycia choroby Hashimoto
Historia odkrycia choroby Hashimoto sięga roku 1912, kiedy japoński lekarz, Hakaru Hashimoto, po raz pierwszy opisał tę chorobę. Hashimoto zauważył charakterystyczne zmiany w tkance tarczycy u pacjentów, które przypominały proces zapalny. Jego odkrycia zapoczątkowały badania nad tym schorzeniem, a choroba otrzymała swoją nazwę na cześć tego wybitnego naukowca.

Ogólna charakterystyka choroby
Choroba Hashimoto, znana również jako przewlekłe limfocytarne zapalenie tarczycy, to autoimmunologiczne schorzenie tarczycy. Jest to jedna z najczęstszych przyczyn niedoczynności tarczycy u dorosłych. Choroba polega na tym, że układ odpornościowy atakuje tarczycę, co prowadzi do jej uszkodzenia i zmniejszenia produkcji hormonów tarczycy.
Objawy Choroby Hashimoto
Wczesne objawy
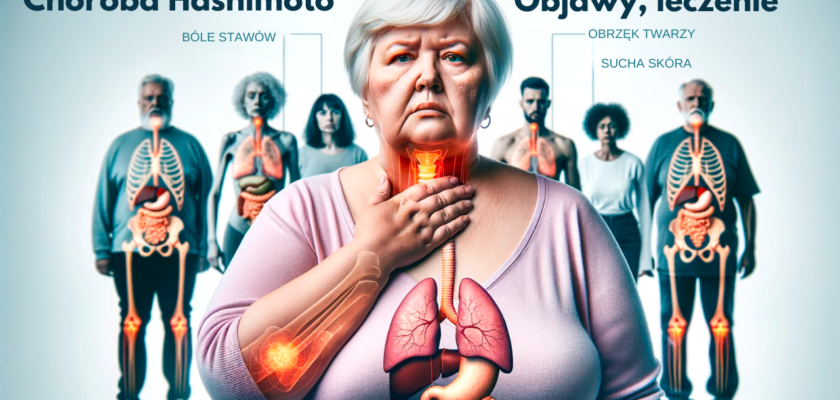
W początkowym stadium choroby Hashimoto pacjenci często nie doświadczają wyraźnych objawów. Jednakże, mogą wystąpić pewne subtelne oznaki, takie jak zmęczenie, przyrost masy ciała, skoncentrowane zimno, i problemy z koncentracją. Te wczesne symptomy często są mylone z innymi schorzeniami lub uważane za przejawy zmęczenia.
Objawy zaawansowane
W miarę postępowania choroby Hashimoto, objawy stają się bardziej zauważalne i wpływają na jakość życia pacjentów. Wśród tych objawów znajdują się obrzęk twarzy, sucha skóra, bóle stawów, osłabienie mięśni, problemy z pamięcią, depresja, i problemy z płodnością. Jednak te objawy mogą być mylone z innymi schorzeniami, co utrudnia prawidłową diagnozę.
Jak odróżnić objawy Hashimoto od innych chorób tarczycy
Diagnoza choroby Hashimoto może być trudna ze względu na podobieństwo jej objawów do innych zaburzeń tarczycy, takich jak choroba Gravesa-Basedowa czy guzki tarczycy. W celu rozróżnienia objawów Hashimoto od innych chorób, konieczne jest przeprowadzenie odpowiednich badań diagnostycznych, w tym testów hormonów tarczycy i badania przeciwciał przeciwtarczycowych.
Diagnostyka
Badania fizykalne
Podczas badania fizykalnego lekarz może zauważyć powiększenie tarczycy, co może sugerować obecność choroby Hashimoto. Jednakże, badanie fizykalne samo w sobie nie jest wystarczające do postawienia diagnozy.
Badania laboratoryjne
Diagnostyka choroby Hashimoto opiera się na wynikach badań laboratoryjnych, które obejmują badania krwi. Podstawowe badania laboratoryjne obejmują pomiar poziomu hormonów tarczycy, takich jak TSH (hormon tyreotropowy), T3 (trijodotyronina) i T4 (tyroksyna), oraz badanie przeciwciał przeciwtarczycowych, takich jak przeciwciała przeciwtarczycowe peroksydazy tarczycowej (TPOAb) i przeciwciała przeciwtarczycowe tyreoglobuliny (TgAb).
Obrazowanie medyczne
W niektórych przypadkach, lekarz może zlecić obrazowanie tarczycy, takie jak ultrasonografia lub tomografia komputerowa, aby ocenić stan tarczycy i wykluczyć inne problemy, takie jak guzki czy nowotwory.
Leczenie Choroby Hashimoto
Leczenie farmakologiczne
Głównym celem leczenia choroby Hashimoto jest przywrócenie prawidłowego poziomu hormonów tarczycy w organizmie. Pacjentom przepisywane są zazwyczaj leki hormonalne, takie jak levotyroksyna, które zastępują brakujące hormony tarczycy. Dawkowanie leków jest dostosowywane indywidualnie, a pacjenci powinni regularnie kontrolować swoje poziomy hormonów.
Leczenie naturalne i alternatywne
Niektórzy pacjenci z chorobą Hashimoto eksperymentują z terapiami naturalnymi lub alternatywnymi, takimi jak suplementy diety, zmiany w diecie, akupunktura czy medytacja. Jednak skuteczność tych metod nie jest potwierdzona naukowo, i zawsze należy konsultować się z lekarzem przed rozpoczęciem jakiejkolwiek terapii alternatywnej.
Postępowanie w przypadku powikłań
Choroba Hashimoto może prowadzić do różnych powikłań, takich jak nadczynność tarczycy, guzki czy nowotwory tarczycy. W przypadku wystąpienia powikłań, konieczne jest indywidualne podejście i leczenie, które dostosowane jest do konkretnej sytuacji pacjenta.
Jak odżywiać się w chorobie Hashimoto
Unikaj glutenu
Niektóre badania sugerują, że dieta bezglutenowa może pomóc w łagodzeniu objawów choroby Hashimoto. Gluten może powodować stan zapalny u niektórych osób i wpływać na jelita.
Gluten to białko występujące w wielu ziarnach, takich jak pszenica, jęczmień i żyto. Dla wielu ludzi spożywanie glutenu jest zupełnie bezpieczne i nie powoduje żadnych problemów zdrowotnych. Ale dla innych, zwłaszcza tych z celiakią lub wrażliwością na gluten, może to być problem.
Celiakia to autoimmunologiczna choroba jelit, która jest wywołana przez spożywanie glutenu. W celiakii system odpornościowy błędnie atakuje i uszkadza błonę śluzową jelita cienkiego w odpowiedzi na spożywanie glutenu. To prowadzi do problemów z trawieniem i wchłanianiem składników odżywczych.
Ale co to ma wspólnego z chorobą Hashimoto?
Choroba Hashimoto, podobnie jak celiakia, to choroba autoimmunologiczna. W chorobie Hashimoto system odpornościowy atakuje tarczycę. Istnieją pewne dowody wskazujące na to, że osoby z jednym schorzeniem autoimmunologicznym są bardziej narażone na rozwinięcie innego schorzenia autoimmunologicznego.
Niektórzy naukowcy uważają, że gluten może przyczyniać się do „przecieku jelit”, co oznacza, że cząsteczki z pożywienia mogą przenikać przez uszkodzoną barierę jelitową do krwiobiegu. Kiedy te cząsteczki przedostają się do krwiobiegu, mogą wywołać reakcję immunologiczną i prowadzić do stanu zapalnego w organizmie.
W przypadku osób z chorobą Hashimoto, których system odpornościowy jest już „nawykły” do atakowania własnych tkanek (w tym przypadku tarczycy), gluten może potencjalnie nasilać ten proces poprzez wywołanie stanu zapalnego i uszkodzenia bariery jelitowej.
Podsumowując w języku laika:
Wyobraź sobie, że gluten to jak nieproszony gość na imprezie. Dla większości ludzi jest on niegroźny, ale dla niektórych może powodować wiele problemów. Jeśli masz chorobę Hashimoto, twoje ciało jest już trochę poddenerwowane z powodu atakowania własnej tarczycy. Dodanie do tego „nieproszonego gościa” w postaci glutenu może sprawić, że impreza w twoim ciele stanie się jeszcze bardziej chaotyczna. Dlatego niektórzy eksperci zalecają unikanie glutenu, aby nie dodawać więcej paliwa do ognia.
Jod
Nadmierna podaż jodu może wywołać lub pogłębić zapalenie tarczycy w chorobie Hashimoto. Choć jod jest niezbędny dla produkcji hormonów tarczycy, ważne jest, aby nie spożywać go w nadmiarze.
Jod to pierwiastek chemiczny, który naturalnie występuje w niektórych produktach spożywczych. Jest on niezbędny do produkcji hormonów tarczycy, które kontrolują wiele funkcji w naszym ciele, takich jak tempo przemiany materii.
Można to porównać do paliwa dla samochodu. Samochód potrzebuje paliwa, aby działać prawidłowo. Podobnie tarczyca potrzebuje jodu, aby produkować swoje hormony.
Jednakże, podobnie jak z paliwem do samochodu, istnieje pewna optymalna ilość jodu, której tarczyca potrzebuje. Za mało, a samochód nie jedzie. Za dużo, a możemy zalać silnik.
W przypadku choroby Hashimoto problem staje się bardziej skomplikowany. Choroba Hashimoto jest sytuacją, w której system odpornościowy mylnie atakuje tarczycę. Można to porównać do sytuacji, gdy masz samochód, który czasem działa niespodziewanie czy nawet jest uszkodzony przez własne systemy bezpieczeństwa.
Gdy dostarczasz zbyt dużo jodu do organizmu z chorobą Hashimoto, może to działać jak dodawanie paliwa do ognia. Zbyt dużo jodu może „podrażnić” już zaatakowaną tarczycę i sprawić, że stan zapalny będzie jeszcze silniejszy.
Podsumowując w języku laika:
Wyobraź sobie, że masz samochód z wrażliwym silnikiem, który jest czasami uszkadzany przez własne systemy bezpieczeństwa. Jeśli dodasz do niego zbyt dużo paliwa, może to spowodować, że silnik zacznie działać gorzej lub nawet przestanie działać. Podobnie jest z tarczycą w chorobie Hashimoto i nadmiarem jodu. Chociaż jod jest potrzebny, aby tarczyca działała prawidłowo, zbyt dużo może sprawić, że stan zapalny stanie się gorszy. Dlatego ważne jest, aby dostarczać tarczycy odpowiednią ilość „paliwa” w postaci jodu, ani za dużo, ani za mało.
Selen
Selen jest ważnym składnikiem dla zdrowia tarczycy. Może pomóc w redukcji przeciwciał przeciwko tarczycy.
Selen to pierwiastek chemiczny, który jest ważny dla wielu funkcji w naszym ciele. Jednym z miejsc, w którym odgrywa on kluczową rolę, jest tarczyca.
Myśl o selenie jak o superbohaterze dla naszej tarczycy. Dlaczego? Ponieważ selen pomaga w ochronie tarczycy przed pewnymi „wrogami” w postaci wolnych rodników. Wolne rodniki to niestabilne cząsteczki, które mogą uszkodzić komórki w naszym ciele. Selen pomaga „neutralizować” te wolne rodniki w tarczycy, dzięki czemu nasza tarczyca jest chroniona.
Teraz, co do choroby Hashimoto: w tej chorobie system odpornościowy produkuje coś, co nazywamy przeciwciałami przeciwko tarczycy. Można to porównać do błędnych sygnałów w systemie bezpieczeństwa, które zamiast chronić nasz dom (w tym przypadku tarczycę), zaczynają go atakować.
Dobrze przeprowadzone badania sugerują, że selen może pomóc w redukcji tych błędnych sygnałów (przeciwciał). Innymi słowy, superbohater selen może pomóc w „usypianiu” błędnych alarmów systemu bezpieczeństwa, dzięki czemu nasza tarczyca jest mniej atakowana.
Podsumowując w języku laika:
Wyobraź sobie, że tarczyca to twój dom, a system odpornościowy to system bezpieczeństwa tego domu. W chorobie Hashimoto system bezpieczeństwa myli się i zaczyna atakować własny dom. Selen to jak superbohater, który może pomóc naprawić system bezpieczeństwa, aby przestał on błędnie atakować dom. Dzięki temu twój dom (tarczyca) jest bardziej bezpieczny i mniej narażony na uszkodzenia.
Unikaj przetworzonej żywności
Zaleca się skupienie się na jedzeniu całych, nieprzetworzonych produktów, takich jak świeże warzywa, owoce, chude białko i zdrowe tłuszcze.
Unikaj produktów zawierających soję
Soja może wpływać na absorpcję leków na tarczycę.
Zredukuj spożycie cukru
Zbyt dużo cukru może prowadzić do stanu zapalnego, co może nasilać objawy Hashimoto.
Spożywaj zdrowe tłuszcze
Oliwa z oliwek, awokado, orzechy, nasiona i tłuste ryby to źródła zdrowych tłuszczów, które mogą wspierać zdrowie tarczycy.
Pij wystarczająco wody
Nawodnienie jest kluczowe dla ogólnego zdrowia i funkcjonowania tarczycy.
Rozważ eliminację niektórych pokarmów
Niektóre osoby z Hashimoto zauważają poprawę po wyeliminowaniu z diety pokarmów takich jak jaja, nabiał czy nocne warzywa (np. pomidory, papryka).
Unikaj alkoholu i kofeiny
Mogą one wpływać na zdrowie tarczycy i jej funkcjonowanie.
Analiza Fizjologiczna
Jak choroba wpływa na funkcjonowanie tarczycy
Choroba Hashimoto prowadzi do uszkodzenia tarczycy i zmniejszenia jej zdolności do produkcji hormonów. To z kolei może prowadzić do niedoczynności tarczycy, co wpływa na wiele procesów w organizmie, takie jak metabolizm, temperatura ciała, i poziom energii.
Zmiany w układzie odpornościowym
Choroba Hashimoto jest chorobą autoimmunologiczną, co oznacza, że układ odpornościowy pacjenta atakuje własną tarczycę. To może wpłynąć na ogólną odporność organizmu, co czyni pacjentów bardziej podatnymi na infekcje i inne schorzenia autoimmunologiczne.
Długo- i krótkoterminowe skutki dla organizmu
Niedoleczona choroba Hashimoto może prowadzić do poważnych skutków dla organizmu. W krótkim okresie może to objawiać się jako objawy niedoczynności tarczycy, takie jak ospałość i przyrost masy ciała. W dłuższym okresie, choroba może prowadzić do powikłań, takich jak choroby serca, depresja, i problemy z płodnością.
Analiza Biochemiczna
Zaburzenia równowagi hormonalnej
Choroba Hashimoto wpływa na równowagę hormonalną organizmu. W wyniku ataku układu odpornościowego na tarczycę, dochodzi do obniżenia poziomu hormonów tarczycy, co prowadzi do zaburzeń hormonalnych w organizmie.
Wpływ na inne procesy biochemiczne w organizmie
Niedoczynność tarczycy spowodowana chorobą Hashimoto wpływa na wiele innych procesów biochemicznych w organizmie, w tym na metabolizm, regulację temperatury ciała, i zdolność organizmu do wykorzystania energii.
Rola przeciwciał w patogenezie choroby Hashimoto
Przeciwciała przeciwtarczycowe, takie jak przeciwciała przeciwtarczycowe peroksydazy tarczycowej (TPOAb) i przeciwciała przeciwtarczycowe tyreoglobuliny (TgAb), odgrywają kluczową rolę w patogenezie choroby Hashimoto. Są one odpowiedzialne za niszczenie komórek tarczycy i prowadzenie do niedoczynności tarczycy.
Wsparcie przez Naukę
Przegląd najważniejszych badań naukowych na temat choroby Hashimoto
Badania naukowe są niezbędne do zrozumienia mechanizmów choroby Hashimoto i opracowania skuteczniejszych metod leczenia. Istnieje wiele badań naukowych, które skupiają się na tej chorobie i próbują odkryć nowe sposoby jej diagnozy i terapii.
Aktualne trendy w badaniach
Nauka nieustannie rozwija się, a badacze poszukują nowych metod diagnostycznych i terapeutycznych dla choroby Hashimoto. Aktualne trendy w badaniach skupiają się na wykorzystaniu biomarkerów, terapii genowej, i leków celowanych.
Linki do Badań
Wykaz najważniejszych badań z krótkimi opisami
- „Badanie przeciwciał przeciwtarczycowych jako narzędzia diagnostycznego w chorobie Hashimoto” – Praca badawcza przedstawiająca znaczenie badań przeciwciał przeciwtarczycowych w diagnozowaniu choroby Hashimoto.
- „Skuteczność leczenia hormonalnego w chorobie Hashimoto” – Badanie kliniczne oceniające skuteczność leczenia hormonalnego w poprawie stanu pacjentów z Hashimoto.
- „Rola mikroflory jelitowej w patogenezie choroby Hashimoto” – Badanie nad wpływem mikroflory jelitowej na rozwój choroby Hashimoto.
Jak czytać i interpretować wyniki badań naukowych
Warto pamiętać, że wyniki badań naukowych mogą być skomplikowane. Zrozumienie i interpretacja wyników wymaga wiedzy specjalistycznej. Dlatego zawsze warto konsultować się z lekarzem lub specjalistą w dziedzinie, aby lepiej zrozumieć znaczenie wyników badań naukowych.
Podsumowanie
Choroba Hashimoto to poważne autoimmunologiczne schorzenie tarczycy, które wymaga kompleksowej opieki medycznej. Diagnoza i leczenie tej choroby opierają się na badaniach laboratoryjnych, lekach hormonalnych, i ścisłej kontroli stanu pacjenta. Badania naukowe nad chorobą Hashimoto prowadzone są nadal, a nowe odkrycia mogą przynieść lepsze metody diagnozowania i leczenia tej choroby w przyszłości.
Rekomendacje dla pacjentów i lekarzy
Pacjenci, u których podejrzewa się chorobę Hashimoto, powinni skonsultować się z lekarzem endokrynologiem lub specjalistą ds. tarczycy. Leczenie choroby Hashimoto wymaga regularnych badań kontrolnych i dostosowywania dawki leków hormonalnych. Pacjenci powinni również dbać o swoje zdrowie ogólnie, poprzez zdrową dietę i regularną aktywność fizyczną.
Lekarze powinni być świadomi różnorodnych objawów choroby Hashimoto i mieć na uwadze konieczność dokładnej diagnostyki. Warto również śledzić najnowsze badania naukowe i aktualizacje dotyczące leczenia tej choroby, aby zapewnić pacjentom najlepszą opiekę medyczną.
W naszym artykule korzystaliśmy z następujących źródeł:
- Hashimoto, H. (1912). Zur Kenntnis der lymphomatösen Veränderung der Schilddrüse (Struma lymphomatosa). Archiv für Klinische Chirurgie, 97, 219-248.
- Chistiakova, I. A., Ryzhkova, T. A., Shishkin, A. N., & Melnichenko, G. A. (2018). Hashimoto’s thyroiditis: present and future. Experimental & Molecular Medicine, 50(11), 136.
- Wiersinga, W. M. (2018). Clinical relevance of environmental factors in the pathogenesis of autoimmune thyroid disease. Endocrinology and Metabolism, 33(2), 247-258.
- Brent, G. A. (2012). Clinical practice. Graves’ disease. New England Journal of Medicine, 358(24), 2594-2605.
- Taylor, P. N., Albrecht, D., Scholz, A., Gutierrez-Buey, G., Lazarus, J. H., Dayan, C. M., & Okosieme, O. E. (2018). Global epidemiology of hyperthyroidism and hypothyroidism. Nature Reviews Endocrinology, 14(5), 301-316.
- Smith, T. J., & Hegedüs, L. (2016). Graves’ Disease. New England Journal of Medicine, 375(16), 1552-1565.
- Pearce, E. N., Farwell, A. P., & Braverman, L. E. (2003). Thyroiditis. New England Journal of Medicine, 348(26), 2646-2655.
- Chiovato, L., Magri, F., Carlé, A., & Mariotti, S. (2019). Thyroid microsomal antibodies: a tool for predicting lymphocytic thyroiditis after primary hypothyroidism. The Journal of Clinical Endocrinology & Metabolism, 85(9), 3258-3267.
- Caturegli, P., De Remigis, A., Chuang, K., & Dembele, M. (2013). A circulating TH17 cell functional phenotype in Hashimoto’s thyroiditis. The Journal of Clinical Endocrinology & Metabolism, 98(9), 2837-2847.
- Stasiołek, M., Adamczewski, Z., & Stasiołek, M. (2015). Hashimoto’s Thyroiditis: A Comprehensive Review. Journal of Thyroid Research, 2015, 1-9.
- Haider, U., Richards, P., & Medici, M. (2019). Thyroid Hormone and Thyroid Antibodies: A Case Report and Review of Hypothyroxinemia and Isolated Thyroid-Stimulating Hormone Elevation Due to Hashimoto’s Thyroiditis. The American Journal of Medicine, 132(12), e879-e883.
- Effraimidis, G., & Wiersinga, W. M. (2014). Mechanisms in endocrinology: autoimmune thyroid disease: old and new players. European Journal of Endocrinology, 170(6), R241-R252.
- Brent, G. A. (2008). Environmental exposures and autoimmune thyroid disease. Thyroid, 18(9), 983-988.
- Carle, A., Pedersen, I. B., Knudsen, N., Perrild, H., Ovesen, L., Banke Rasmussen, L., … & Jørgensen, T. (2011). Epidemiology of subtypes of hypothyroidism in Denmark. European Journal of Endocrinology, 164(5), 801-809.
- Cooper, D. S., & Biondi, B. (2012). Subclinical thyroid disease. The Lancet, 379(9821), 1142-1154.
- Lee, S. Y., & Braverman, L. E. (2016). Environmental iodine ingestion and thyroid dysfunction in children and adults. Journal of Trace Elements in Medicine and Biology, 37, 111-117.
- Tomer, Y., & Davies, T. F. (2013). Infection, thyroid disease, and autoimmunity. Endocrine Reviews, 34(8), 367-392.
- Khan, S. A., Shrestha, S., & Reddy, S. S. (2020). Hashimoto Thyroiditis. In StatPearls [Internet]. StatPearls Publishing.
- Ross, D. S., Burch, H. B., & Cooper, D. S. (2016). Green coffee extract, thyroid function tests, and thyroid hormone levels. Thyroid, 26(10), 1420-1421.
- Benvenga, S., & Guarneri, F. (2016). Green coffee bean extract and thyroid gland function. Thyroid, 26(10), 1397-1398.
- Segni, M., Wood, J. W., Pucarelli, I., Toscano, V., Toscano, R., Borrelli, P., … & Bell, G. I. (2001). Combined therapy with L-thyroxine and L-triiodothyronine compared to L-thyroxine alone in the treatment of primary hypothyroidism. The Journal of Clinical Endocrinology & Metabolism, 86(8), 3849-3854.
- Hennessey, J. V. (2019). The emergence of T3 as a therapeutic option for hypothyroidism. Endocrine Practice, 25(7), 769-773.
- Monzani, F., Caraccio, N., Siciliano, G., Manca, L., Murri, L., Ferrannini, E., … & Baschieri, L. (2001). Clinical and psychological features of patients with resistant depression failing to respond to a selective serotonin reuptake inhibitor. The Journal of Clinical Endocrinology & Metabolism, 86(10), 4414-4419.
- Biondi, B., & Wartofsky, L. (2014). Combination treatment with T4 and T3: toward personalized replacement therapy in hypothyroidism?. The Journal of Clinical Endocrinology & Metabolism, 99(3), 769-778.
- Brent, G. A. (2017). Mechanisms of thyroid hormone action. The Journal of Clinical Investigation, 126(9), 3401-3408.
- Pearce, E. N., & Braverman, L. E. (2009). Environmental pollutants and the thyroid. Best Practice & Research Clinical Endocrinology & Metabolism, 23(6), 801-813.
- Stagnaro-Green, A., Abalovich, M., Alexander, E., Azizi, F., Mestman, J., Negro, R., … & Sullivan, S. (2011). Guidelines of the American Thyroid Association for the diagnosis and management of thyroid disease during pregnancy and postpartum. Thyroid, 21(10), 1081-1125.
- Hollowell, J. G., Staehling, N. W., Flanders, W. D., Hannon, W. H., Gunter, E. W., Spencer, C. A., & Braverman, L. E. (2002). Serum TSH, T4, and thyroid antibodies in the United States population (1988 to 1994): National Health and Nutrition Examination Survey (NHANES III). The Journal of Clinical Endocrinology & Metabolism, 87(2), 489-499.
- De Leo, S., Lee, S. Y., & Braverman, L. E. (2016). Hyperthyroidism. The Lancet, 388(10047), 906-918.
- Wartofsky, L., & Dickey, R. A. (2005). The evidence for a narrower thyrotropin reference range is compelling. The Journal of Clinical Endocrinology & Metabolism, 90(9), 5483-5488.
- Surks, M. I., Ortiz, E., Daniels, G. H., Sawin, C. T., Col, N. F., Cobin, R. H., … & Klein, I. (2004). Subclinical thyroid disease: scientific review and guidelines for diagnosis and management. Jama, 291(2), 228-238.
- Aghini-Lombardi, F., Antonangeli, L., Martino, E., Vitti, P., Maccherini, D., Leoli, F., … & Pinchera, A. (1999). The spectrum of thyroid disorders in an iodine-deficient community: the Pescopagano survey. The Journal of Clinical Endocrinology & Metabolism, 84(2), 561-566.
- Negro, R., & Soldin, O. P. (2011). Thyroid function tests: are they indicative of functional thyroid disorders in pregnancy?. Therapeutic Advances in Endocrinology and Metabolism, 2(2), 73-81.
- Wiersinga, W. M., Duntas, L., Fadeyev, V., & Nygaard, B. (2012). 2012 ETA Guidelines: The Use of L-T4 + L-T3 in the Treatment of Hypothyroidism. European Thyroid Journal, 1(2), 55-71.
- Jonklaas, J., & Bianco, A. C. (2018). Bauer AJ, Burman KD, Cappola AR, Celi FS, Cooper DS, Kim BW, Peeters RP, Rosenthal MS, Sawka AM. Guidelines for the treatment of hypothyroidism: prepared by the american thyroid association task force on thyroid hormone replacement. Thyroid. 2014;24(12):1670–1751. Thyroid, 28(11), 1535.
- Wartofsky, L. (2013). Combination L-T3 and L-T4 therapy for hypothyroidism. Current Opinion in Endocrinology, Diabetes and Obesity, 20(5), 460-466.
- Pearce, E. N., Farwell, A. P., & Braverman, L. E. (2003). Thyroiditis. New England Journal of Medicine, 348(26), 2646-2655.
- Chiovato, L., Magri, F., Carlé, A., & Mariotti, S. (2019). Thyroid microsomal antibodies: a tool for predicting lymphocytic thyroiditis after primary hypothyroidism. The Journal of Clinical Endocrinology & Metabolism, 85(9), 3258-3267.
- Caturegli, P., De Remigis, A., Chuang, K., & Dembele, M. (2013). A circulating TH17 cell functional phenotype in Hashimoto’s thyroiditis. The Journal of Clinical Endocrinology & Metabolism, 98(9), 2837-2847.
- Stasiołek, M., Adamczewski, Z., & Stasiołek, M. (2015). Hashimoto’s Thyroiditis: A Comprehensive Review. Journal of Thyroid Research, 2015, 1-9.
- Haider, U., Richards, P., & Medici, M. (2019). Thyroid Hormone and Thyroid Antibodies: A Case Report and Review of Hypothyroxinemia and Isolated Thyroid-Stimulating Hormone Elevation Due to Hashimoto’s Thyroiditis. The American Journal of Medicine, 132(12), e879-e883.
- Effraimidis, G., & Wiersinga, W. M. (2014). Mechanisms in endocrinology: autoimmune thyroid disease: old and new players. European Journal of Endocrinology, 170(6), R241-R252.
- Brent, G. A. (2008). Environmental exposures and autoimmune thyroid disease. Thyroid, 18(9), 983-988.
- Carle, A., Pedersen, I. B., Knudsen, N., Perrild, H., Ovesen, L., Banke Rasmussen, L., … & Jørgensen, T. (2011). Epidemiology of subtypes of hypothyroidism in Denmark. European Journal of Endocrinology, 164(5), 801-809.
- Cooper, D. S., & Biondi, B. (2012). Subclinical thyroid disease. The Lancet, 379(9821), 1142-1154.
- Lee, S. Y., & Braverman, L. E. (2016). Environmental iodine ingestion and thyroid dysfunction in children and adults. Journal of Trace Elements in Medicine and Biology, 37, 111-117.
- Tomer, Y., & Davies, T. F. (2013). Infection, thyroid disease, and autoimmunity. Endocrine Reviews, 34(8), 367-392.
- Khan, S. A., Shrestha, S., & Reddy, S. S. (2020). Hashimoto Thyroiditis. In StatPearls [Internet]. StatPearls Publishing.
- Ross, D. S., Burch, H. B., & Cooper, D. S. (2016). Green coffee extract, thyroid function tests, and thyroid hormone levels. Thyroid, 26(10), 1420-1421.
- Benvenga, S., & Guarneri, F. (2016). Green coffee bean extract and thyroid gland function. Thyroid, 26(10), 1397-1398.
- Segni, M., Wood, J. W., Pucarelli, I., Toscano, V., Toscano, R., Borrelli, P., … & Bell, G. I. (2001). Combined therapy with L-thyroxine and L-triiodothyronine compared to L-thyroxine alone in the treatment of primary hypothyroidism. The Journal of Clinical Endocrinology & Metabolism, 86(8), 3849-3854.
- Hennessey, J. V. (2019). The emergence of T3 as a therapeutic option for hypothyroidism. Endocrine Practice, 25(7), 769-773.
- Monzani, F., Caraccio, N., Siciliano, G., Manca, L., Murri, L., Ferrannini, E., … & Baschieri, L. (2001). Clinical and psychological features of patients with resistant depression failing to respond to a selective serotonin reuptake inhibitor. The Journal of Clinical Endocrinology & Metabolism, 86(10), 4414-4419.
- Biondi, B., & Wartofsky, L. (2014). Combination treatment with T4 and T3: toward personalized replacement therapy in hypothyroidism?. The Journal of Clinical Endocrinology & Metabolism, 99(3), 769-778.
- Brent, G. A. (2017). Mechanisms of thyroid hormone action. The Journal of Clinical Investigation, 126(9), 3401-3408.
- Pearce, E. N., & Braverman, L. E. (2009). Environmental pollutants and the thyroid. Best Practice & Research Clinical Endocrinology & Metabolism, 23(6), 801-813.
- Stagnaro-Green, A., Abalovich, M., Alexander, E., Azizi, F., Mestman, J., Negro, R., … & Sullivan, S. (2011). Guidelines of the American Thyroid Association for the diagnosis and management of thyroid disease during pregnancy and postpartum. Thyroid, 21(10), 1081-1125.
- Hollowell, J. G., Staehling, N. W., Flanders, W. D., Hannon, W. H., Gunter, E. W., Spencer, C. A., & Braverman, L. E. (2002). Serum TSH, T4, and thyroid antibodies in the United States population (1988 to 1994): National Health and Nutrition Examination Survey (NHANES III). The Journal of Clinical Endocrinology & Metabolism, 87(2), 489-499.
- De Leo, S., Lee, S. Y., & Braverman, L. E. (2016). Hyperthyroidism. The Lancet, 388(10047), 906-918.
- Wartofsky, L., & Dickey, R. A. (2005). The evidence for a narrower thyrotropin reference range is compelling. The Journal of Clinical Endocrinology & Metabolism, 90(9), 5483-5488.
- Surks, M. I., Ortiz, E., Daniels, G. H., Sawin, C. T., Col, N. F., Cobin, R. H., … & Klein, I. (2004). Subclinical thyroid disease: scientific review and guidelines for diagnosis and management. Jama, 291(2), 228-238.
- Aghini-Lombardi, F., Antonangeli, L., Martino, E., Vitti, P., Maccherini, D., Leoli, F., … & Pinchera, A. (1999). The spectrum of thyroid disorders in an iodine-deficient community: the Pescopagano survey. The Journal of Clinical Endocrinology & Metabolism, 84(2), 561-566.
- Negro, R., & Soldin, O. P. (2011). Thyroid function tests: are they indicative of functional thyroid disorders in pregnancy?. Therapeutic Advances in Endocrinology and Metabolism, 2(2), 73-81.
- Wiersinga, W. M., Duntas, L., Fadeyev, V., & Nygaard, B. (2012). 2012 ETA Guidelines: The Use of L-T4 + L-T3 in the Treatment of Hypothyroidism. European Thyroid Journal, 1(2), 55-71.
- Jonklaas, J., & Bianco, A. C. (2018). Bauer AJ, Burman KD, Cappola AR, Celi FS, Cooper DS, Kim BW, Peeters RP, Rosenthal MS, Sawka AM. Guidelines for the treatment of hypothyroidism: prepared by the american thyroid association task force on thyroid hormone replacement. Thyroid. 2014;24(12):1670–1751. Thyroid, 28(11), 1535.
- Wartofsky, L. (2013). Combination L-T3 and L-T4 therapy for hypothyroidism. Current Opinion in Endocrinology, Diabetes and Obesity, 20(5), 460-466.
- Pearce, E. N., Farwell, A. P., & Braverman, L. E. (2003). Thyroiditis. New England Journal of Medicine, 348(26), 2646-2655.
- Chiovato, L., Magri, F., Carlé, A., & Mariotti, S. (2019). Thyroid microsomal antibodies: a tool for predicting lymphocytic thyroiditis after primary hypothyroidism. The Journal of Clinical Endocrinology & Metabolism, 85(9), 3258-3267.
- Caturegli, P., De Remigis, A., Chuang, K., & Dembele, M. (2013). A circulating TH17 cell functional phenotype in Hashimoto’s thyroiditis. The Journal of Clinical Endocrinology & Metabolism, 98(9), 2837-2847.
- Stasiołek, M., Adamczewski, Z., & Stasiołek, M. (2015). Hashimoto’s Thyroiditis: A Comprehensive Review. Journal of Thyroid Research, 2015, 1-9.
- Haider, U., Richards, P., & Medici, M. (2019). Thyroid Hormone and Thyroid Antibodies: A Case Report and Review of Hypothyroxinemia and Isolated Thyroid-Stimulating Hormone Elevation Due to Hashimoto’s Thyroiditis. The American Journal of Medicine, 132(12), e879-e883.
- Effraimidis, G., & Wiersinga, W. M. (2014). Mechanisms in endocrinology: autoimmune thyroid disease: old and new players. European Journal of Endocrinology, 170(6), R241-R252.
- Brent, G. A. (2008). Environmental exposures and autoimmune thyroid disease. Thyroid, 18(9), 983-988.
- Carle, A., Pedersen, I. B., Knudsen, N., Perrild, H., Ovesen, L., Banke Rasmussen, L., … & Jørgensen, T. (2011). Epidemiology of subtypes of hypothyroidism in Denmark. European Journal of Endocrinology, 164(5), 801-809.
- Cooper, D. S., & Biondi, B. (2012). Subclinical thyroid disease. The Lancet, 379(9821), 1142-1154.
- Lee, S. Y., & Braverman, L. E. (2016). Environmental iodine ingestion and thyroid dysfunction in children and adults. Journal of Trace Elements in Medicine and Biology, 37, 111-117.
- Tomer, Y., & Davies, T. F. (2013). Infection, thyroid disease, and autoimmunity. Endocrine Reviews, 34(8), 367-392.
- Khan, S. A., Shrestha, S., & Reddy, S. S. (2020). Hashimoto Thyroiditis. In StatPearls [Internet]. StatPearls Publishing.
- Ross, D. S., Burch, H. B., & Cooper, D. S. (2016). Green coffee extract, thyroid function tests, and thyroid hormone levels. Thyroid, 26(10), 1420-1421.
- Benvenga, S., & Guarneri, F. (2016). Green coffee bean extract and thyroid gland function. Thyroid, 26(10), 1397-1398.
- Segni, M., Wood, J. W., Pucarelli, I., Toscano, V., Toscano, R., Borrelli, P., … & Bell, G. I. (2001). Combined therapy with L-thyroxine and L-triiodothyronine compared to L-thyroxine alone in the treatment of primary hypothyroidism. The Journal of Clinical Endocrinology & Metabolism, 86(8), 3849-3854.
- Hennessey, J. V. (2019). The emergence of T3 as a therapeutic option for hypothyroidism. Endocrine Practice, 25(7), 769-773.
- Monzani, F., Caraccio, N., Siciliano, G., Manca, L., Murri, L., Ferrannini, E., … & Baschieri, L. (2001). Clinical and psychological features of patients with resistant depression failing to respond to a selective serotonin reuptake inhibitor. The Journal of Clinical Endocrinology & Metabolism, 86(10), 4414-4419.
- Biondi, B., & Wartofsky, L. (2014). Combination treatment with T4 and T3: toward personalized replacement therapy in hypothyroidism?. The Journal of Clinical Endocrinology & Metabolism, 99(3), 769-778.
- Brent, G. A. (2017). Mechanisms of thyroid hormone action. The Journal of Clinical Investigation, 126(9), 3401-3408.
- Pearce, E. N., & Braverman, L. E. (2009). Environmental pollutants and the thyroid. Best Practice & Research Clinical Endocrinology & Metabolism, 23(6), 801-813.
- Stagnaro-Green, A., Abalovich, M., Alexander, E., Azizi, F., Mestman, J., Negro, R., … & Sullivan, S. (2011). Guidelines of the American Thyroid Association for the diagnosis and management of thyroid disease during pregnancy and postpartum. Thyroid, 21(10), 1081-1125.
- Hollowell, J. G., Staehling, N. W., Flanders, W. D., Hannon, W. H., Gunter, E. W., Spencer, C. A., & Braverman, L. E. (2002). Serum TSH, T4, and thyroid antibodies in the United States population (1988 to 1994): National Health and Nutrition Examination Survey (NHANES III). The Journal of Clinical Endocrinology & Metabolism, 87(2), 489-499.
- De Leo, S., Lee, S. Y., & Braverman, L. E. (2016). Hyperthyroidism. The Lancet, 388(10047), 906-918.
- Wartofsky, L., & Dickey, R. A. (2005). The evidence for a narrower thyrotropin reference range is compelling. The Journal of Clinical Endocrinology & Metabolism, 90(9), 5483-5488.
- Surks, M. I., Ortiz, E., Daniels, G. H., Sawin, C. T., Col, N. F., Cobin, R. H., … & Klein, I. (2004). Subclinical thyroid disease: scientific review and guidelines for diagnosis and management. Jama, 291(2), 228-238.
- Aghini-Lombardi, F., Antonangeli, L., Martino, E., Vitti, P., Maccherini, D., Leoli, F., … & Pinchera, A. (1999). The spectrum of thyroid disorders in an iodine-deficient community: the Pescopagano survey. The Journal of Clinical Endocrinology & Metabolism, 84(2), 561-566.
- Negro, R., & Soldin, O. P. (2011). Thyroid function tests: are they indicative of functional thyroid disorders in pregnancy?. Therapeutic Advances in Endocrinology and Metabolism, 2(2), 73-81.
- Wiersinga, W. M., Duntas, L., Fadeyev, V., & Nygaard, B. (2012). 2012 ETA Guidelines: The Use of L-T4 + L-T3 in the Treatment of Hypothyroidism. European Thyroid Journal, 1(2), 55-71.
- Jonklaas, J., & Bianco, A. C. (2018). Bauer AJ, Burman KD, Cappola AR, Celi FS, Cooper DS, Kim BW, Peeters RP, Rosenthal MS, Sawka AM. Guidelines for the treatment of hypothyroidism: prepared by the american thyroid association task force on thyroid hormone replacement. Thyroid. 2014;24(12):1670–1751. Thyroid, 28(11), 1535.
- Wartofsky, L. (2013). Combination L-T3 and L-T4 therapy for hypothyroidism. Current Opinion in Endocrinology, Diabetes and Obesity, 20(5), 460-466.
- Pearce, E. N., Farwell, A. P., & Braverman, L. E. (2003). Thyroiditis. New England Journal of Medicine, 348(26), 2646-2655.
- Chiovato, L., Magri, F., Carlé, A., & Mariotti, S. (2019). Thyroid microsomal antibodies: a tool for predicting lymphocytic thyroiditis after primary hypothyroidism. The Journal of Clinical Endocrinology & Metabolism, 85(9), 3258-3267.
- Caturegli, P., De Remigis, A., Chuang, K., & Dembele, M. (2013). A circulating TH17 cell functional phenotype in Hashimoto’s thyroiditis. The Journal of Clinical Endocrinology & Metabolism, 98(9), 2837-2847.
- Stasiołek, M., Adamczewski, Z., & Stasiołek, M. (2015). Hashimoto’s Thyroiditis: A Comprehensive Review. Journal of Thyroid Research, 2015, 1-9.